Replagalとは何ですか?
Replagalは、有効成分のアガルシダーゼアルファを含む点滴用の溶液です。
Replagalは何に使用されますか?
Replagalは、まれな遺伝性疾患であるファブリー病の患者を治療するために使用されます。
この病気に苦しむ患者は、酵素α-ガラクトシダーゼAが不足しています。この酵素は通常、脂質グロボトリアオシルセラミド(Gb3)を分解します。この酵素が不足していると、Gb3は分解できず、細胞、たとえば細胞に蓄積します。 。腎臓。
ファブリー病の患者は、腎不全、心臓病、脳卒中などの重篤な病気を含む幅広い症状を示す可能性があります。
ファブリー病の患者数が少ないため、この病気は「希少」と見なされ、2000年8月8日にレプラガルは「孤児薬」(希少疾患の治療に使用される薬)に指定されました。
薬は処方箋がなければ入手できません。
Replagalはどのように使用されますか?
Replagalは、ファブリー病またはその他の先天性代謝性疾患の治療を専門とする医師の監督下で投与する必要があります。 0.2mg / kg体重の静脈内注入として2週間ごとに40分間投与されます。子供に与えられたレプラガルの効果がいくつかの研究で調べられており、したがってレプラガルは7歳から7歳までの子供に使用できることが示唆されています。同じ用量で18年。重度の腎臓の問題を抱えている患者は、治療に対する反応が低くなります。 Replagalは長期間の使用を目的としています。
Replagalはどのように機能しますか?
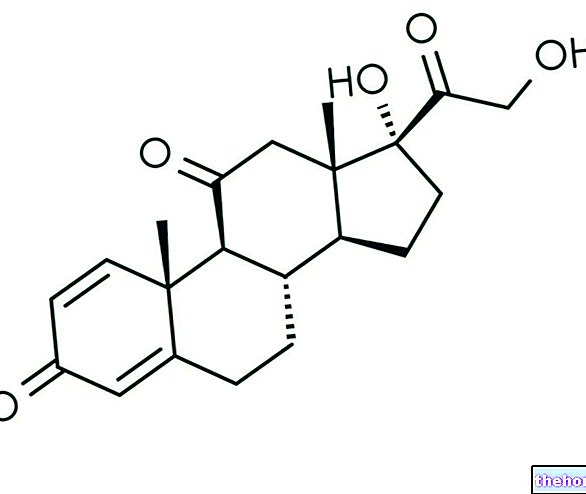
レプラガルは、患者さんに不足している酵素を提供する酵素補充療法です。レプラガルは、ファブリー病の人に不足しているヒト酵素α-ガラクトシダーゼAを補充することを目的としています。 Replagalの活性物質であるアガルシダーゼアルファは、「組換えDNA技術」と呼ばれる方法で生成されたヒト酵素のコピーです。酵素は、酵素を生成できるようにする遺伝子(DNA)を受け取った細胞によって生成されます。 。この置換酵素はGb3の分解を促進し、細胞内への蓄積を防ぎます。
Replagalはどのように研究されてきましたか?
Replagalは、合計40人の男性患者を対象とした2つの臨床試験で研究されています。 Replagalはプラセボ(ダミー治療)と比較されました。ある研究では、痛みに対するその効果が測定され、別の研究では、左心室(心筋)からのGb3の除去に対するその効果が調べられました。15人の女性患者(保因者)での研究も行われました。
Replagalは、6歳半から18歳までの24人の子供でも研究されています。
研究中にReplagalはどのような利点を示しましたか?
治療の6か月後、Replagalは、プラセボ(ダミー治療)を受けた患者と比較して、治療を受けた患者の痛みを大幅に軽減しました。 Replagalは左心室の質量を平均11.5g減少させましたが、プラセボで治療された患者は21.8gの増加を経験しました。これらの結果は、病気の症状が改善するか、病気が安定していることを示しています。女性では、効果は男性で見られた結果と同等でした。 6ヶ月のReplagal治療を受けた子供は心臓量の増加を示さず、血中Gb3レベルは減少しました。
Replagalに関連するリスクは何ですか?
最も一般的な副作用(研究中に10人に1人以上の患者に見られる)は、薬自体ではなく注入によって引き起こされます。これらは主に悪寒、頭痛、吐き気、発熱(発熱)、顔面紅潮および倦怠感(倦怠感)、一般的に深刻ではありません。他の非常に一般的な副作用には、痛みや不快感が含まれます。子供に報告される副作用は、大人に見られるものと同様です。Replagalで報告される副作用の完全なリストについては、パッケージリーフレットを参照してください。 。
Replagalを服用している患者は、抗体(Replagalに対する反応として生成されるタンパク質で、治療を損なう可能性があります)を発症する可能性があります。
Replagalは、アガルシダーゼアルファまたは他の薬の成分に対して過敏(アレルギー)の可能性がある人には使用しないでください。
Replagalが承認されたのはなぜですか?
ヒト用医薬品委員会(CHMP)は、ファブリー病の患者にとって、レプラガルによる治療は長期的に臨床的利益を生み出すことができると決定しました。 CHMPは、Replagalの利益はそのリスクよりも大きいと判断し、医薬品の販売承認を与えることを推奨しました。
Replagalは、希少疾患の治療に使用されているため、この薬に関するより詳細な情報を入手できなかったため、「例外的な状況」で認可されました。欧州医薬品庁(EMEA)は、毎年入手可能な新しい情報を確認し、この要約は必要に応じて更新されます。
Replagalにはまだどのような情報が待っていますか?
Replagalを製造している会社は、主に5年間の治療、他の用量、維持用量、および小児での研究から結果を得るために、この薬に関するさらなる研究を実施します。
Replagalに関する詳細情報
2001年8月3日、欧州委員会はTKT Europe ABに、欧州連合全体で有効なReplagalの「MarketingAuthorization」を付与しました。「MarketingAuthorization」は2006年8月3日に更新されました。Replagalの孤立ステータス登録については、ここをクリックしてください。
ReplagalのEPARのフルバージョンについては、ここをクリックしてください。
この要約の最終更新:2007年2月
このページで公開されているReplagal-Agalsidaseアルファに関する情報は、古くなっているか、不完全である可能性があります。この情報の正しい使用法については、免責事項と有用な情報のページを参照してください。